L'estimation échographique du poids ftal (EPF) à terme : plus de mal que de bien ? Pr Basky Thilaganathan Ultrasound Obstet Gynecol 2018; 52: 58
Introduction
L'évaluation de la croissance est un élément constant de la surveillance ftale, que ce soit par la palpation manuelle, par la mesure de la hauteur utérine ou par la biométrie échographique ftale.
L'identification des ftus petits pour l'âge gestationnel (PAG) est progressivement devenue un objectif important de notre pratique. Il est essentiel de se rappeler que la pratique du dépistage du PAG est justifiée en raison de l'association du retard de croissance intra utérin (RCIU) avec un risque accru de mortinatalité, de décès néonatal et de déficits neurologiques (1,2).
Le mécanisme biologique invoqué pour ces complications est que l'insuffisance placentaire induit une croissance ftale médiocre, une hypoxémie ftale et par là, une issue défavorable.
Quelle référence biométrique devrions-nous utiliser ?
La controverse en cours concernant le bon choix des courbes de biométrie ftale pour dépister le PAG et le RCIU ne semble pas sur le point de sachever. Innombrables sont les discussions sur la pertinence de l'utilisation de l'une ou l'autre des quelques 100 courbes de biométrie ftale publiées.
Les partisans de lutilisation de références "nationales" pour l'évaluation individuelle justifient leurs points de vue sur la base, complètement injustifiée, que le poids du bébé serait déterminé par le passeport détenu par sa mère. D'autres soulignent que la majorité des références biométriques ftales ont été développés en utilisant de facto des ftus nés prématurés - considérés à tort comme normaux et susceptibles de fausser la distribution du poids ftal attendu vers le bas en raison d'une pathologie diagnostiquée éventuellement non détectée.
Pour surmonter ce type de biais, Nicolaides et al. dans ce numéro de Ultrasound in Obstetrics and Gynecology (July 2018), présentent des résultats qui développent et valident l'utilisation de données foetales pour la construction d'une référence sur la croissance ftale et le poids à la naissance (3,4). Ces auteurs suggèrent justement que la variation entre les différentes courbes publiées est susceptible d'être principalement la conséquence de différences dans les populations d'étude à partir de laquelle elles ont été développées. Ils alimentent encore le débat en suggérant qu'une norme internationale unique (pour tous les pays) n'est pas appropriée car elle sous-estimerait les PAG dans les pays avec des "gros bébés normaux", tels que la Norvège, et surestimerait les PAG dans les pays ayant des petits bébés normaux", tels que l'Inde. Ce faisant, les auteurs postulent que le poids d'un bébé est déterminé par l'origine ethnique de ses parents et que la proportion de naissances de PAG devrait être la même (10%) dans tous les pays.
Pourquoi ne pas utiliser INTERGROWTH-21st comme standard international de référence ?
On dit souvent que les femmes asiatiques ont des bébés plus petits. La question fondamentale est de savoir si les femmes asiatiques ont des petits bébés parce qu'elles sont elles-mêmes plus petites ou est-ce que des femmes asiatiques et caucasiennes de même taille et toutes deux en bonne santé auraient des bébés finalement de poids similaire.
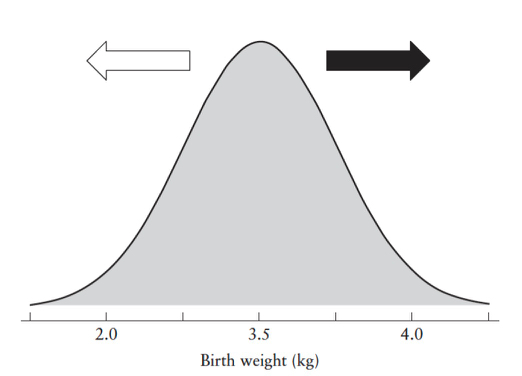
Le consortium INTERGROWTH-21st (IG-21) a mené une étude bien construite et contrôlée pour répondre à cette question et a conclu que l'origine ethnique, en soi, n'influençait pas la croissance du ftus. L'ethnicité apparait comme un marqueur indirect des conditions de nutrition et de l'état de santé - Ces deux facteurs contribuent à une moindre croissance ftale lorsquils sont altérés (5). Cela confirme l'intuition naturelle des cliniciens qui observent des bébés plus petits dans les populations des pays en voie de développement et les migrants économiques / réfugiés vers les pays à revenu élevé. De même, cela soppose à l'affirmation selon laquelle le taux de PAG devrait être identique dans tous les pays. Un standard de croissance tel que IG-21 ne sous-estime pas les PAG chez les femmes des pays à revenu élevé comme la Norvège. La réalité est que ces pays ont des taux dobésité de 20-30% - même dans l'enfance - et par conséquent, il est logique et normal que l'évaluation ftale "sur diagnostique" la macrosomie ftale et "sous diagnostique" le PAG dans ce contexte (Figure 1). De même, le standard de croissance IG-21 "surestime" les PAG lorsqu'il est utilisée dans les pays à faible revenu comme l'Inde, où le taux de retard de croissance est de 20 à 30% chez les enfants en bas âge! Le sur diagnostic apparent de PAG dans ces pays à faible revenu est d'ailleurs cohérent avec les taux augmentés de mortinatalité, décès périnatal et retard neurologique observés en bas âge dans ces pays.
Dautres normes de croissance ftale, telles que celles de l'Organisation Mondiale de la Santé (6), ont été développées en utilisant une méthodologie similaire à celle d'IG-21. Cependant, des critères de sélection ou de monitorage de létude moins stricts ont pu entraîner l'inclusion de femmes prédisposées au PAG ou à la macrosomie et, par conséquent, ont influencés la distribution finale des biométries dans ces normes.
Diagnostic et prise en charge des RCIU précoces
Le récent consensus DELPHI établit des recommandations cliniques pour l'identification des RCIU à début précoce (10). La publication concomitante des dernières données de l'essai TRUFFLE fournit également des preuves solides que ces RCIU précoces nécessitent une surveillance rapprochée basée à la fois sur l'enregistrement cardiotocographique informatisée ainsi que sur lévaluation Doppler du ductus venosus (11).
Ces données fournissent ainsi un cadre pragmatique pour le suivi et la planification de la naissance des RCIU précoces préalablement identifiés, avec d'excellents résultats et plus de 90% de survie en bonne santé dans cette cohorte à haut risque de prématurité.
Le poids ftal est-il un bon marqueur des issues défavorables des RCIU à terme ?
L'intérêt porté en pratique clinique sur lEstimation du Poids Ftal à terme est fondé sur le risque de mortinatalité et le souhait de pouvoir extraire le futur bébé avant quune issue défavorable n'intervienne.
Cependant, contrairement à ce qui se passe plus tôt dans la grossesse, la MFIU à terme frappe majoritairement (dans 60-70% des cas) des ftus non PAG (12). Il est également vraisemblable que beaucoup de MFIU à terme soient classées par erreur comme PAG en raison de la perte de poids ftal survenant postmortem, par macération et déshydratation (13). Sebire et ses collègues, dans une revue de plus de 1000 ftus post-mortem, ont ainsi estimé que la plupart des ftus avaient perdu plus de 20% de leur poids entre la survenue de la mort in utero et la pesée effectuée après la naissance. Il y a sans aucun doute une association entre PAG et mortinatalité, mais une politique de santé axée principalement sur l'identification des ftus PAG à terme ne permettra pas d'empêcher la majorité des MFIU et des mort périnatales. Cela serait aussi limité quune politique de dépistage de la trisomie 21 qui ne serait basée que sur lâge maternel (13).
L'estimation de la croissance ftale est-elle utile ?
La faible association entre la biométrie ftale seule et la mortalité périnatale à terme est reconnue, au moins officieusement, dans de nombreux programmes de dépistage qui favorisent plutôt lévaluation dynamique de la vitesse de croissance ftale pendant la grossesse.
La vitesse de croissance du ftus est une composante complexe à appréhender et à évaluer et la possibilité quune altération de la croissance ftale puisse prédire la mort périnatale et les issues défavorables reste à établir.
Les seuils dalarme concernant une déviation de la croissance ftale doivent sûrement dépendre de l'âge gestationnel, du terme du début de linsuffisance placentaire, de l'importance de la déviation à la croissance normale, de la capacité du ftus à supporter une situation compromise.
Il serait erroné de supposer quun seuil unique d'écart de croissance pourrait servir à identifier et prévenir la mortinatalité à n'importe quel âge gestationnel. Ainsi, dans l'étude POP dans laquelle les femmes ont été randomisées entre surveillance de grossesse de routine ou échographies en série, laltération de la vitesse de croissance du ftus était significativement associée à des issues défavorables, mais uniquement dans le groupe des ftus PAG, cette relation nétant pas observée chez les ftus qui avaient un poids approprié à l'âge gestationnel (14).
Pourquoi les RCIU précoces et tardifs sont-ils si différents ?
Notre compréhension des RCIU est rendue difficile par l'hypothèse erronée d'une association directe entre la biométrie ftale et lissue défavorable, c'est-à-dire quun faible poids ftal conduit "directement" à un risque accru de mortalité néonatale.
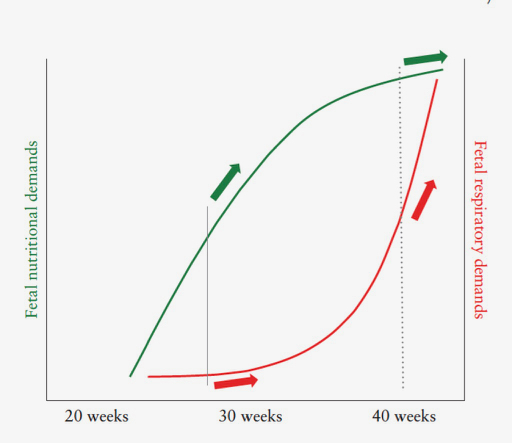
Le placenta est un organe multifonctionnel complexe responsable entre autres de la nutrition, de l'oxygénation et de l'épuration. La dysfonction placentaire a un impact à la fois nutritionnel et respiratoire sur le ftus en développement et pour comprendre ses conséquences, il faut tout d'abord apprécier les besoins nutritionnels et respiratoires du ftus au cours de la grossesse. Les besoins nutritionnels ftaux suivent une courbe logarithmique alors que les besoins respiratoires suivent eux une croissance exponentielle (Figure 3).
La dysfonction placentaire à début précoce affectera donc la nutrition / croissance ftale bien plus que la fonction respiratoire, expliquant pourquoi les cas de RCIU à début précoce perdurent des semaines avant de nécessiter la naissance du ftus pour prévenir l'hypoxie et ses conséquences. En revanche, la dysfonction placentaire à terme affectera de façon exponentielle et quasi immédiate les besoins respiratoires ftaux à un moment où les demandes nutritionnelles ont déjà plafonné. Ainsi, à terme, un ftus de 3 kg affecté par une dysfonction placentaire peut souffrir de la dysfonction oxygénatoire et donc d'hypoxie sans avoir eu le temps de ne pas grandir !
Le PAG/RCIU est un signe de dysfonction placentaire précoce, mais on ne le trouve que rarement lorsque le désordre conséquent ne se manifeste que tardivement.
Quelles sont les causes de RCIU à apparition tardive ?
Classiquement, le RCIU est lié à un mauvais développement du placenta. Cependant, de grandes études histologiques prospectives en aveugle des placentas à terme ont montré un manque de marqueurs histologiques pour les PAG ou la pré-éclampsie (PE) (15,16).
La seule lésion associée avec le PAG et la PE est un dépôt de fibrine périveineux, c'est à dire un défaut sur le versant maternel du placenta attribué à l'hypoperfusion maternelle du lit placentaire. En support de ces résultats, le groupe de recherche du professeur Khalil a montré dans ce numéro encore (UOG July 2018) les associations entre l'insuffisance de perfusion utérine au troisième trimestre (sans altération du développement du trophoblastes) et le décès périnatal (17,18). Ces données sont également cohérentes avec de récentes découvertes sur l'insuffisance cardiovasculaire maternelle à terme comme une voie physiopathologique de développement d'une dysfonctionnement placentaire et d'une pré-éclampsie.
Comment détecter les troubles oxygénatoires des foetus à terme?
A côté de la croissance ftale considérée comme un mauvais marqueur de risque d'une issue défavorable à terme, dautres marqueurs de l'hypoxémie sont apparus.
Lévaluation du Doppler artériel ftal, que ce soit en utilisant le rapport cérébroplacentaire (CPR) ou le rapport ombilicocérébral, a montré une relation plus significative avec la mort périnatale que la biométrie ftale (19). Même les études qui ont retrouvé une faible prédiction du CPR pour la mortalité à la naissance, ont démontré de manière convaincante que ce rapport était deux à trois fois plus performant que lidentification dun PAG pour prédire une issue défavorable (20). Une récente revue systématique de 128 études impliquant plus de 47 000 femmes, a ainsi démontré que le rapport cérébroplacentaire était plus performant que la biométrie ftale, le Doppler de lartère ombilicale ou celui de l'artère cérébrale moyenne dans la prédiction de la mort foetale et des issues défavorables (21,22). Avant que lévaluation du CPR ne soit promptement mise en uvre dans la pratique clinique, des résultats dessais correctement conduits et dimensionnés sur ces marqueurs à terme pour prédire la mort périnatale et les issues défavorables sont requis.
REFERENCES
1. Malin GL, Morris RK, Riley RD, Teune MJ, Khan KS. When is birthweight at term
(≥37 weeks gestation) abnormally low? A systematic review and meta-analysis of
the prognostic and predictive ability of current birthweight standards for childhood
and adult outcomes. BJOG 2015; 122: 634642.
2. Arcangeli T, Thilaganathan B, Hooper R, Khan KS, Bhide A. Neurodevelopmental
delay in small babies at term: a systematic review. Ultrasound Obstet Gynecol 2012;
40: 267275.
3. Nicolaides KH, Wright D, Syngelaki A, Wright A, Akolekar R. Fetal Medicine
Foundation fetal and neonatal population weight charts. Ultrasound Obstet Gynecol
2018; 52: 4451.
4. Hammami A, Mazer Zumaeta A, Syngelaki A, Akolekar R, Nicolaides KH.
Ultrasonographic estimation of fetal weight: development of new model and
assessment of performance of previous models. Ultrasound Obstet Gynecol 2018;
52: 3543.
5. Stirnemann J, Villar J, Salomon LJ, Ohuma E, Ruyan P, Altman DG, Nosten F,
Craik R, Munim S, Cheikh Ismail L, Barros FC, Lambert A, Norris S, Carvalho
M, Jaffer YA, Noble JA, Bertino E, Gravett MG, Purwar M, Victora CG, Uauy R,
Bhutta Z, Kennedy S, Papageorghiou AT; International Fetal and Newborn Growth
Consortium for the 21st Century (INTERGROWTH-21st). International estimated
fetal weight standards of the INTERGROWTH-21st Project. Ultrasound Obstet
Gynecol 2017; 49: 478486.
6. Kiserud T, Piaggio G, Carroli G, WidmerM, Carvalho J, Neerup Jensen L, Giordano
D, Cecatti JG, Abdel Aleem H, Talegawkar SA, Benachi A, Diemert A, Tshefu
Kitoto A, Thinkhamrop J, Lumbiganon P, Tabor A, Kriplani A, Gonzalez Perez R,
Hecher K, Hanson MA, G¨ ulmezoglu AM, Platt LD. The World Health Organization
Fetal Growth Charts: A Multinational Longitudinal Study of Ultrasound Biometric
Measurements and Estimated Fetal Weight. PLoS Med 2017; 14: e1002220.
7. Gardosi J, Giddings S, Clifford S, Wood L, Francis A. Association between reduced
stillbirth rates in England and regional uptake of accreditation training in customised
fetal growth assessment. BMJ Open 2013; 3: e003942.
8. Iliodromiti S, Mackay DF, Smith GCS, Pell JP, Sattar N, Lawlor DA, et al. (2017)
Customised and Noncustomised Birth Weight Centiles and Prediction of Stillbirth
and Infant Mortality and Morbidity: A Cohort Study of 979,912 Term Singleton
Pregnancies in Scotland. PLoS Med 2017; 14: e1002228.
9. Tan MY, Poon LC, Rolnik DL, Syngelaki A, de Paco Matallana C, Akolekar
R, Cicero S, Janga D, Singh M, Molina FS, Persico N, Jani JC, Plasencia W,
Greco E, Papaioannou G, Wright D, Nicolaides KH. Prediction and prevention of
small-for-gestational-age neonates: evidence from SPREE and ASPRE. Ultrasound
Obstet Gynecol 2018; 52: 5259.
10. Gordijn SJ, Beune IM, Thilaganathan B, Papageorghiou A, Baschat AA, Baker PN,
Silver RM,Wynia K, GanzevoortW. Consensus definition of fetal growth restriction:
a Delphi procedure. Ultrasound Obstet Gynecol 2016; 48: 333339.
11. Bilardo CM, Hecher K, Visser GHA, Papageorghiou AT, Marlow N, Thilaganathan
B, Van Wassenaer-Leemhuis A, Todros T, Marsal K, Frusca T, Arabin B, Brezinka
C, Derks JB, Diemert A, Duvekot JJ, Ferrazzi E, Ganzevoort W, Martinelli P,
Ostermayer E, Schlembach D, Valensise H, Thornton J, Wolf H, Lees C; TRUFFLE
Group. Severe fetal growth restriction at 2632 weeks: key messages from the
TRUFFLE study. Ultrasound Obstet Gynecol 2017; 50: 285290.
12. Poon LC, Tan MY, Yerlikaya G, Syngelaki A, Nicolaides KH. Birth weight in live
births and stillbirths. Ultrasound Obstet Gynecol 2016; 48: 602606.
13. Man J, Hutchinson JC, Ashworth M, Heazell AE, Levine S, Sebire NJ. Effects of
intrauterine retention and postmortem interval on body weight following intrauterine
death: implications for assessment of fetal growth restriction at autopsy. Ultrasound
Obstet Gynecol 2016; 48: 574578.
14. Sovio U, White IR, Dacey A, Pasupathy D, Smith GCS. Screening for fetal growth
restriction with universal third trimester ultrasonography in nulliparous women in
the Pregnancy Outcome Prediction (POP) study: a prospective cohort study. Lancet
2015; 386: 20892097.
15. Pathak S, Lees CC, Hackett G, Jessop F, SebireNJ. Frequency and clinical significance
of placental histological lesions in an unselected population at or near term. Virchows
Arch 2011; 459: 565572.
16. Falco ML, Sivanathan J, Laoreti A, Thilaganathan B, Khalil A. Placental
histopathology associated with pre-eclampsia: systematic review and meta-analysis.
Ultrasound Obstet Gynecol 2017; 50: 295301.
17. Binder J, Monaghan C, Thilaganathan B, Carta S, Khalil A. De-novo abnormal
uteroplacental circulation in third trimester: pregnancy outcome and pathological
implications. Ultrasound Obstet Gynecol 2018; 52: 6065.
18. Monaghan C, Binder J, Thilaganathan B, Morales-Rosell ´o J, Khalil A. Perinatal loss
at term: role of uteroplacental and fetal Doppler assessment. Ultrasound Obstet
Gynecol 2018; 52: 7277.
19. Khalil A, Morales-Rosell ´o J, Townsend R, Morlando M, Papageorghiou A, Bhide A,
Thilaganathan B. Value of third-trimester cerebroplacental ratio and uterine artery
Doppler indices as predictors of stillbirth and perinatal loss. Ultrasound Obstet
Gynecol 2016; 47: 7480.
20. Akolekar R, Syngelaki A, Gallo DM, Poon LC, Nicolaides KH. Umbilical and fetal
middle cerebral artery Doppler at 35-37 weeks gestation in the prediction of adverse
perinatal outcome. Ultrasound Obstet Gynecol 2015; 46: 8292.
21. Vollgraff Heidweiller-Schreurs CA, De Boer MA, Heymans MW, Schoonmade
LJ, Bossuyt PMM, Mol BWJ, De Groot CJM, Bax CJ. Prognostic accuracy of
cerebroplacental ratio and middle cerebral artery Doppler for adverse perinatal
outcome: systematic review and meta-analysis. Ultrasound Obstet Gynecol 2018;
51: 313322.
22. Conde-Agudelo A, Villar J, Kennedy SH, Papageorghiou AT. Predictive accuracy
of cerebroplacental ratio for adverse perinatal and neurodevelopmental outcomes in
suspected fetal growth restriction: systematic review and meta-analysis. Ultrasound
Obstet Gynecol 2018. DOI: 10.1002/uog.19117.
23. Dunsworth HM, Warrener AG, Deacon T, Ellison PT, Pontzer H. Metabolic
hypothesis for human altriciality. Proc Natl Acad Sci USA 2012; 109: 1521215216.
Traduit de l'anglais pas R Bessis, N Fries et LJ Salomon